【导读】
多细胞肝球作为一种3D培养模型,可用于肝纤维化治疗的研究,虽然这些模型可以再现纤维化疾病,然而目前通过随机分配方法制造的细胞球不易控制,在大小、功能和效用上存在着差异。近日,来自美国加利福尼亚大学的Adam R Abate团队在Biofabrication上发表题为“Controlled fabrication of functional liver spheroids with microfluidic flow cytometric printing”的研究新成果。研究人员利用微流控流式细胞打印(µFCP)技术,可实现单细胞打印,得到具有确定数量的不同细胞类型的肝球。该技术制造的细胞球在结构与功能上的均匀性均优于随机分配方法生成的细胞球。此外,该技术每小时产生数千个细胞球,可批量制造单细胞精度的球状体,为疾病建模和高通量药物测试提供可扩展平台。
µFCP技术工作原理
细胞识别及分拣是实现精确分配细胞的关键。与传统的FACS工作原理一样,µFCP技术通过荧光和散射特性鉴定出目标细胞,并从流体中分拣出来。不同之处是,该技术提出了介电泳液滴偏转装置,利用导电液滴和周围绝缘空气之间的介电常数差异,实现目标细胞的分拣。该装置体积小至毫米,因此允许靠近接收板,可提高打印精度。当载有目标细胞如肝细胞(HepG2)或肝星状细胞(HSC)的液滴流过分拣区域时,液滴将按需沉积在所需孔内,最终形成功能性肝球(如图1)。

图1 µFCP技术制造功能性肝球示意图
µFCP技术制造的细胞球具有更好的细胞存活率
当用悬浮细胞组成细胞球时,并非所有的细胞都是活的,随机分配法会将死亡的细胞也包含在在细胞球中,导致细胞球的特征发生改变。相比之下,µFCP技术可以使用活性染料辨别出死细胞并将其排除,从而提高细胞球活性。为了验证这一点,研究人员将Calcein AM染色后的细胞分别通过随机分配法和µFCP技术打印在基底上(如图2),结果表明µFCP技术获得的细胞群体具有更高的平均荧光,且暗淡的细胞较少。进一步对细胞群体进行EthD-1染色,也同样观察到µFCP技术下的死细胞更少。
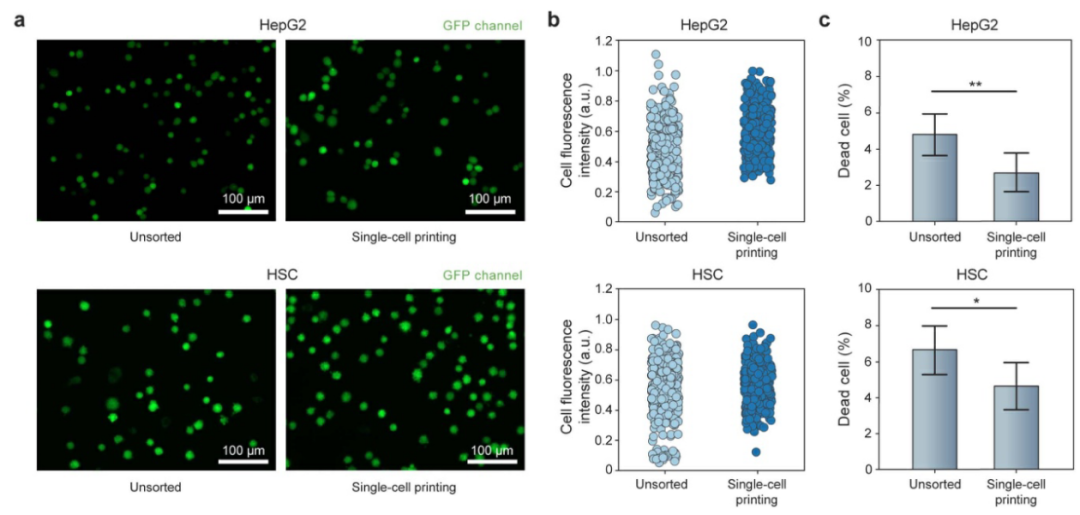
图2 µFCP技术可分拣活细胞,以提高细胞球活性
µFCP技术制造的细胞球大小和细胞组分精准可控
细胞球的大小取决于培养时间和初始细胞数量。为了说明µFCP技术在控制细胞球大小方面的优越性,研究人员使用µFCP和随机分配两种技术打印了不同初始细胞数量。与随机分配方法相比,µFCP技术打印的细胞球尺寸分布更集中(图3a)。为了展现µFCP技术具有精准控制细胞球成分的能力,研究人员使用这两种方法构建了目标成分为10个HepG2和10个HSC的细胞球,µFCP制造的细胞球细胞数量的标准误差明显小于随机分配(图3b),并且在培养六天后的尺寸变化比随机分配所产生的细胞球小三倍(图3c)。
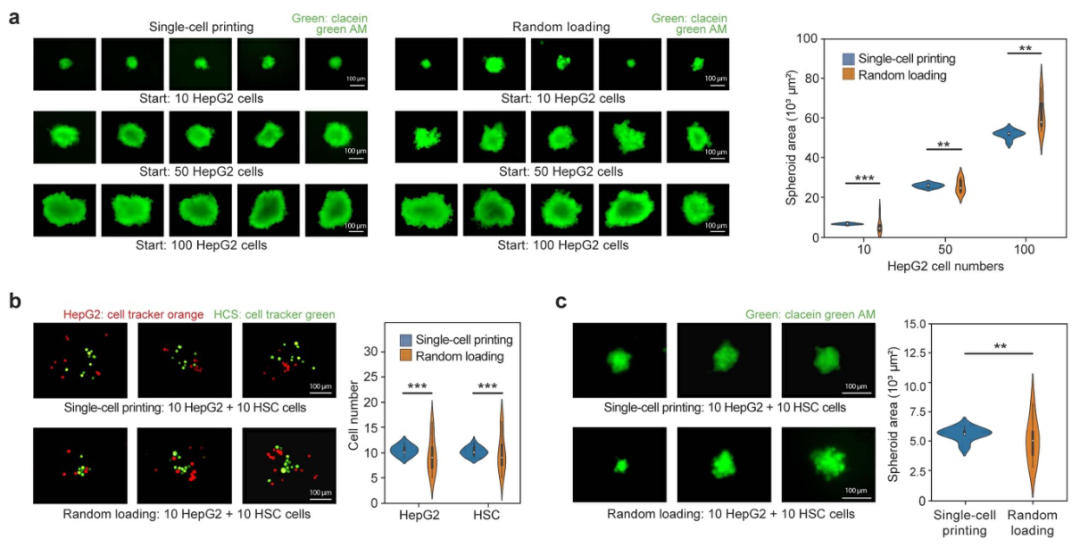
图3 µFCP技术允许打印的细胞数目可控,以获得更均匀的肝细胞球
µFCP技术制造的肝细胞球功能可控
纤维化取决于肝细胞和肝星状细胞之间的相互作用。因此,这些细胞比例的变化可能导致不一致的细胞球功能。为了研究细胞比例对肝球表型和纤维化的影响,研究人员打印了不同比例的HepG2和HSC细胞球,每个细胞球共有100个细胞。培养6天后,细胞球大小随着HSC数量的增加而减小(图4a、b),且球体形态趋于球形(图4c)。但当HSC增加超过60%会导致球体形态不规则。为了更深入地研究这一点,研究人员量化了I型胶原蛋白的生成,当HSC占比低于50%时,I型胶原蛋白总量随HSC数量线性增加,反之下降(图4e、f),这表明当HepG2过少时,HSC不再分泌胶原蛋白。
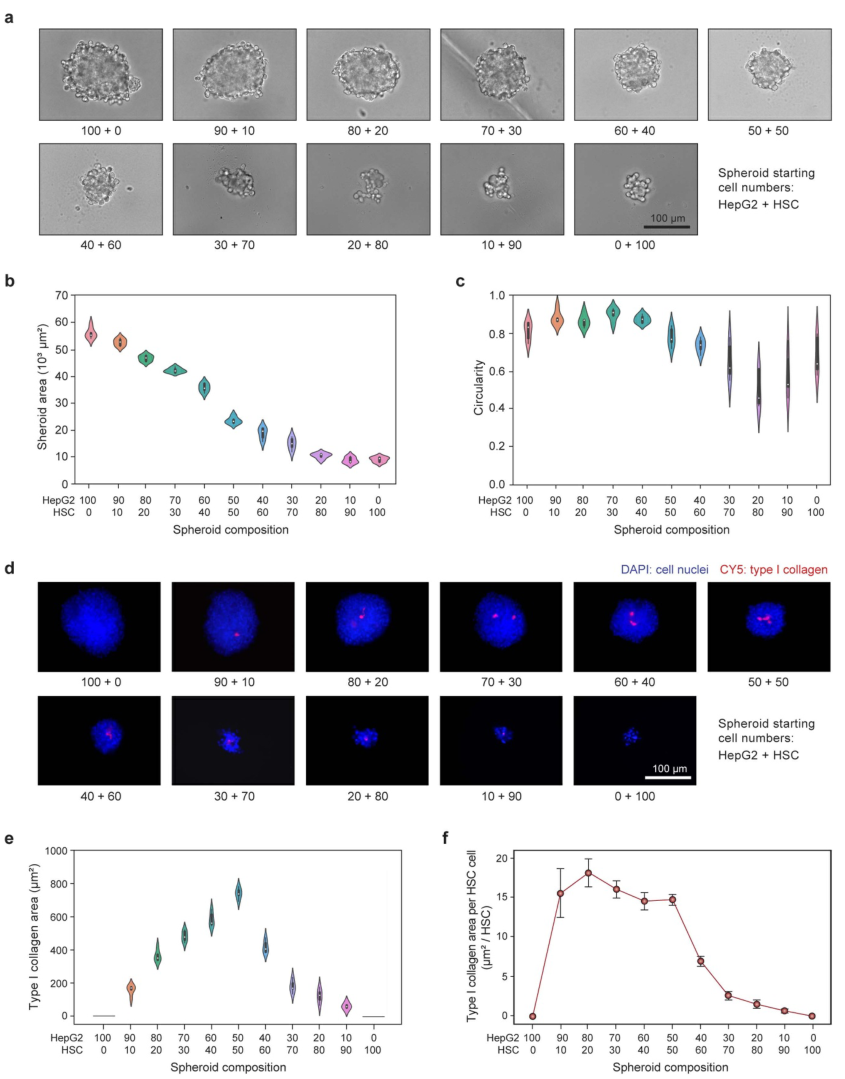
图4 µFCP技术允许系统化研究细胞类型的比例和数量对肝球的影响
µFCP技术制造的细胞球可以实现更精确的药物筛选
使用细胞球进行药物筛选时,其大小和功能均匀性直接影响准确性。由于µFCP允许制造具有优异均匀性的细胞球,因此与随机分配方法相比,它能够实现更精确的筛选。为了评估药物反应的可变性,研究人员通过打印或随机分配的方式,用60个HepG2和40个HSC细胞制作了细胞球(图5a)。然后使用TGF-β1促纤维化化合物处理细胞球,这是一种对HSC活化的有效刺激,可产生I型胶原(图5b、c)。为了比较功能均匀性,研究人员通过计算I型胶原面积来量化I型胶原的数量(图5d),发现TGF-β1显著增加µFCP打印细胞球和随机生成细胞球中的I型胶原,与随机分配的细胞球相比,打印细胞球的测量可变性降低,大大增加了药物影响的统计显著性。
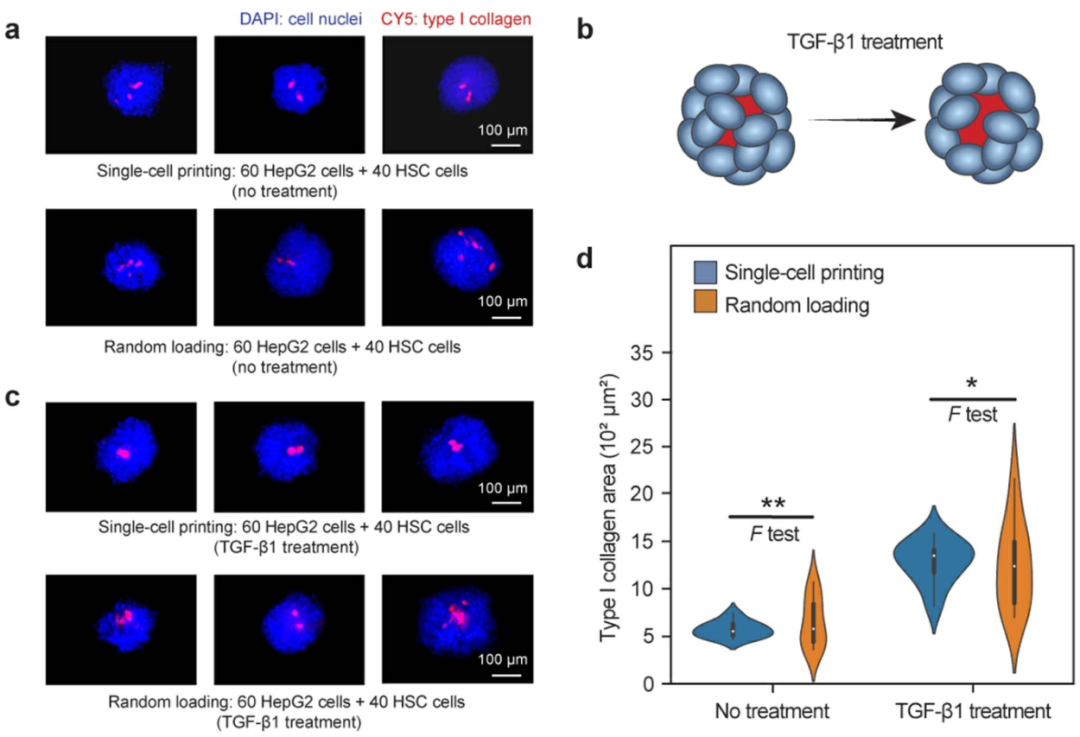
图5 µFCP技术制造的细胞球用于体外药物精准测试
总结
目前基于随机分配制造的肝细胞细胞球存在尺寸和功能可变的问题,这限制了它们再现肝脏生物学和纤维化的重复性,以及作为筛选模型的准确性。研究人员采用的微流控流式细胞打印技术克服了这些问题,确保了细胞球由所需细胞类型的确切数量组成。此外,若将该技术与多路复用光学检测相结合,可进一步增加细胞球的复杂度,这将有利于细胞球功能的精准控制。
【原文信息】
Zhang, P., et al. (2022). "Controlled fabrication of functional liver spheroids with microfluidic flow cytometric printing." Biofabrication 14(4): 045011.
Doi:10.1088/1758-5090/ac8622