【导读】
胚胎细胞生长的环境和胚胎发育受到多种物理因素调控,其中机械力参与塑造整个胚胎的发育过程,例如环境流变学特性的变化、细胞外介质渗透压的变化以及细胞的主动拉伸和压缩。尽管力学信号作为物理因素在生物体中普遍存在,但它们在胚胎发育中的作用及其与化学信号的耦合效应大多都被忽视了。2022年洛克菲勒大学Ali H. Brivanlou教授发表在Nature Reviews Molecular Cell Biology杂志的综述文章Mechanical regulation of early vertebrate embryogenesis 回顾了力学调控早期脊椎动物发育的研究,包括力在组织模式发生和体轴形成方向的作用,介绍了人类胚胎模型体外构建的方法,加深了对人类胚胎发育过程中细胞重排和细胞命运决定的力学调控机制的理解。
胚胎组织的成形
形态发生是一个多尺度的过程,单细胞水平上产生的力和组织尺度上的力均有助于整个发育过程中的模式发生。胚胎细胞利用与细胞骨架相连的运动蛋白对周围环境产生作用力,导致单细胞形态发生运动。胚胎发育中涉及上皮细胞和非上皮细胞的许多形态发生过程都是由细胞上肌动蛋白索的收缩驱动的,这些收缩是通过单个细胞骨架在黏着连接水平上的协调而出现的。此外,产生力的分子结构,比如细胞骨架及其相关蛋白,表现出机械敏感性并可能导致局部产生的变形会被加强放大。在囊胚晚期,胚胎达到的最终大小是由内部压力和滋养外胚层所能承受的压力之间的力学反馈综合决定的(图1)。
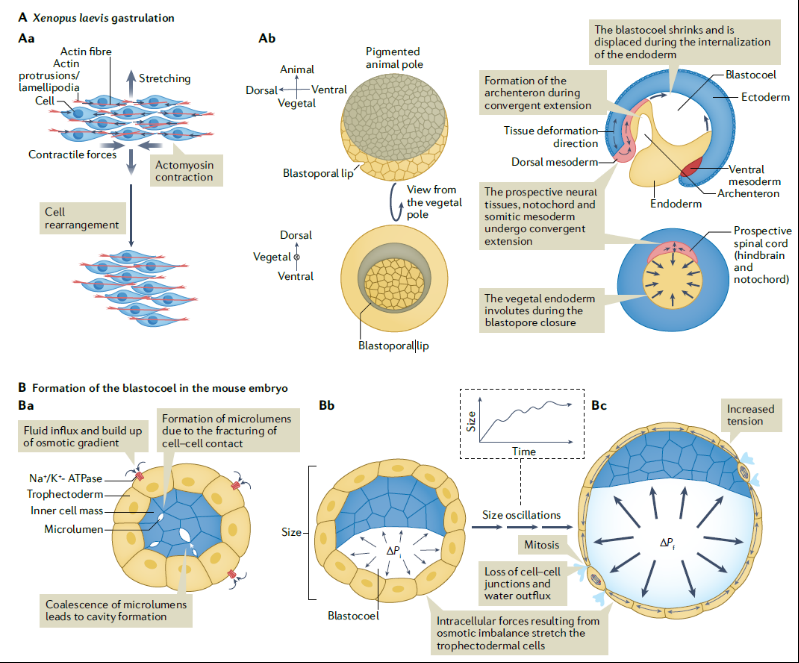
图1 胚胎中的多尺度的力学环境
胚胎组织的形成需要复杂的力学调控,主要是因为细胞自主行为之间的调节回路和跨越细胞场力的并存。胚胎组织表现出固体和液体的混合行为,也称为粘弹性,从而允许不同类型的变形,如,组织可以永久变形,并在较小的力学扰动下维持形态稳定。
生物力学作用下的组织图案化
组织的图案化(tissue patterning)是指从最初完全相同的细胞建立不同基因型区域的过程。在胚胎发生过程中,图案化的一个重要因素是形态发生因子的梯度分布。然而,胚胎细胞不仅能读取和响应形态发生因子梯度,还能解码力学信息。因此,在脊椎动物胚胎中,力学不稳定性和力学转导是组织图案化的重要诱因。力学转导通过WNT配体下游的力学反应要素与WNT通路联系,促进了脊椎动物胚胎发育中形态发生因子和力学之间的相互作用。此外,Hippo信号通路的核心成分是组织和器官尺寸的关键调节因子,在发育过程和癌症中调节组织器官生长和细胞增殖。体外实验表明,细胞骨架张力对YAP/TAZ定位到细胞核是必需的,且独立于经典的Hippo通路级联(图2)。
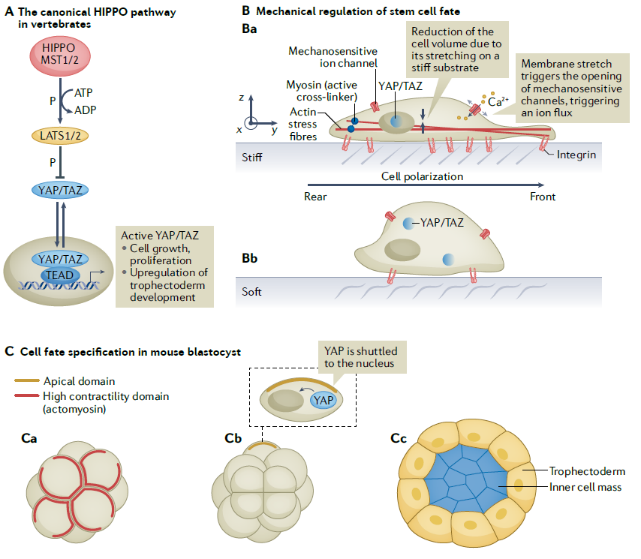
图2 力学因素调控细胞命运
力诱导的对称性破坏
脊椎动物的身体平面不是非对称的,具有前-后、背-腹和左-右三大体轴,机械力可以通过早期对称性破坏事件促进这种模式形成。在非洲爪蛙胚胎中出现的第一个轴是背腹轴,是通过皮质旋转确定(图3A)。脊椎动物胚胎在原肠发生过程中特化出左-右轴,这体现在内脏器官的位置和它们的发育中。传统上认为左-右模式是在前-后轴和背-腹轴出现后立即发生的,是由差异基因表达模式导致,起始于前-后轴左侧Nodal的偏差表达(图3B)。
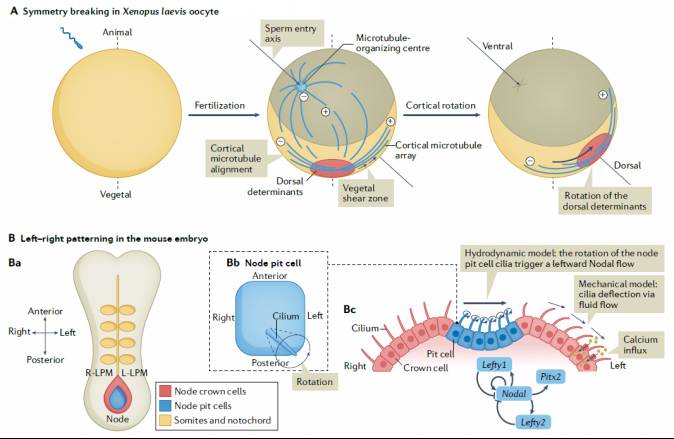
图3 力学因素诱导对称性破坏
组织边界处的力学调控
整个胚胎的模式形成需要建立明确的组织边界和特化不同谱系的胚胎区域。在哺乳动物的发育过程中,第一个谱系分支指定了哪些组织将成为胚胎外组织,哪些组织将构成胚胎。原肠形成初期,胚体细胞分化成三个主要胚层。最终,不同新生细胞类型的收缩性差异确保了组织分离和连续的发育过程中维持组织边界稳定。最近的研究表明,在原肠发生过程中的细胞重排是由不同胚胎细胞群的边界产生的力所驱动的(图4)。值得注意的是,特定胚胎区域的出现需要细胞特化和明确边界的建立。在体外,钙粘蛋白浓度较高的细胞群具有较高的表面张力,并倾向于被表面钙粘蛋白浓度较低的细胞群包围,以使系统的自由粘附能最小化。因此,细胞间界面的分子相互作用在超细胞尺度上产生力并维持不同的细胞命运和组织正确分离。
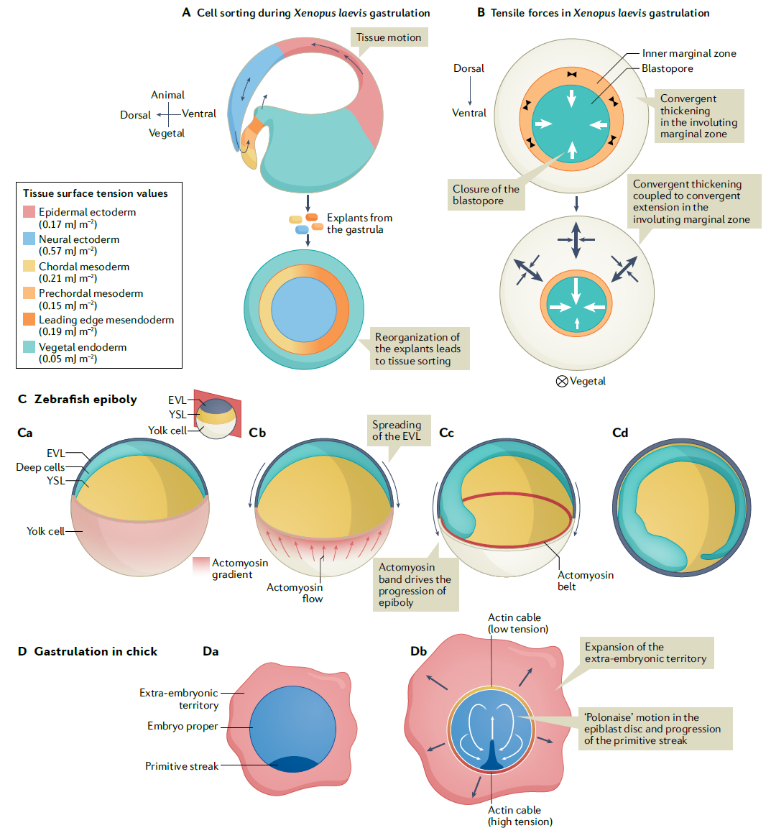
图4 细胞空间重排机制
从体内到体外
如上所述,力学因素是脊椎动物早期发育的重要信号和驱动因素。因此,研究早期胚胎中作用的力,包括它们在单个细胞和组织尺度上的来源、分布和功能,对理解胚胎发生机制至关重要。为此,体外模型的发展近年来受到了广泛关注。它们为重建早期哺乳动物子宫外发育提供了独特的手段,有助于了解哺乳动物发育过程的具体机制。体外发育模型包括整个胚胎组织外植体或胚胎干细胞的自组织聚合体。拟胚体和类器官是研究早期胚胎和器官发育过程中干细胞聚集的三维模型。干细胞在增殖和选择不同命运的同时,也形成了超细胞尺度的3D结构,这些模型可以用来研究环境中力学因素如何诱导三维结构出现。但是,到目前为止,大多数用胚胎干细胞进行的机械敏感性分析都忽略了机械模式的精准调控。
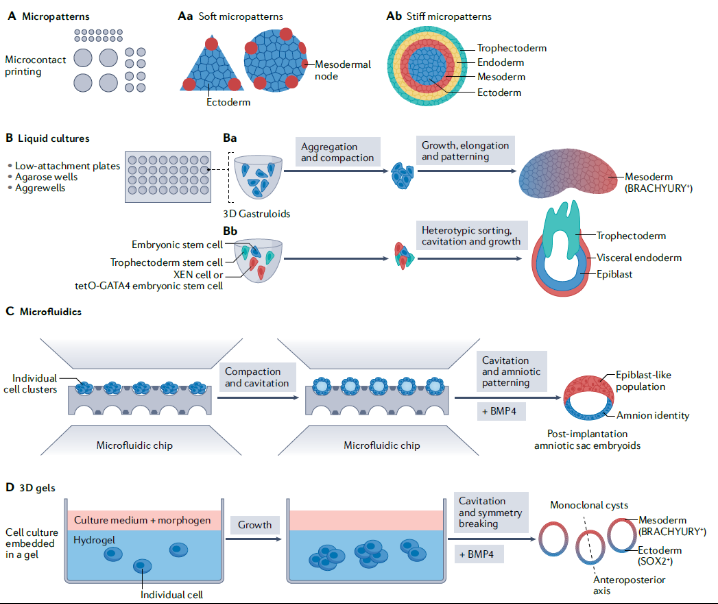
图5 哺乳动物早期发育的干细胞模型
人类胚胎模型中的力学调控
目前,有两种体外平台模拟人类早期发育。一种是天然胚胎的体外植入,以囊胚为起点,可培养至受精后14天(人类)或21天(非人灵长类动物)。其中,囊胚是从母体组织中分离出来的,且胚胎来源宝贵,建立健全的统计研究比较有限。另外一种是人工的胚胎模型,支持在简单和高度定量的平台上研究人类早期胚胎发育期间的力学因素。在二维环境下,细胞通过细胞外基质蛋白的微图案控制黏着于表面。二维的类原肠胚模型表明机械转导影响中内胚层命运特化,细胞集落边缘会产生张力并且特化BRACHYURY的表达区域。在三维环境下,通过微孔或将细胞聚集物嵌入凝胶中实现空间限制。研究显示,上皮-间充质转化的发生与原肠形成相关,且会破坏细胞聚集体的凝聚力,而在体内,上皮-间充质转化短暂的,不会损害胚胎的后续发育。新的研究平台的开发,如仿生凝胶、3D打印细胞环境、微流体腔室和力学激发装置等可以为发育过程中形态发生研究提供更多元的环境。另外,发展实时和高分辨率成像对研究发育过程中形态发生也是至关重要的。
总结和展望
力生物学已经深深影响了发育生物学和人工胚胎研究。结合组织尺度上的体内力场测量与细胞身份实时跟踪技术,可以帮助我们分析组织发育的机制,回答尚未解决的问题。细胞3D打印、类器官等体外技术对于分析多尺度的分子传递是有价值的。同时,体外模型可以在许多不同物种中重复发育研究,可以用相同的平台研究在物种之间保守的力学驱动过程,阐明支配脊椎动物形态发生的主要机制。
【原文信息】Manon Valet, Eric D. Siggia, Ali H. Brivanlou. Mechanical regulation of early vertebrate embryogenesis. Nature Reviews Molecular Cell Biology. 2022, 23, 169–184