【导读】
在传统培养方法中,类器官的形成过程依赖于被动扩散来获取养分和排出废物。然而,在类器官的生长过程中,由于营养物质和氧气向3D水凝胶内部区域的扩散有限,类器官活力大大降低,并逐渐形成坏死核心。由此,需要对类器官进行传代以防止类器官坏死问题。因此建立长时间不间断、连续的类器官培养方法具有较大意义。近期,宾夕法尼亚大学的Dan Dongeun Huh团队在Nature Methods期刊上发表文章Geometric engineering of organoid culture for enhanced organogenesis in a dish,研究人员设计了一个类器官培养平台(OCTOPUS),该平台可将单次注射的干细胞悬浮液转化为类器官的放射状阵列,该阵列可以在不需要传代的情况下长期培养(超过四周)。实验证明,该系统可在加速生产肠类器官的同时显著提升肠类器官的结构和功能成熟度。此外,研究人员还提出了炎性肠病(IBD)患者衍生的类器官模型和用于模拟IBD的先天免疫反应的可灌注血管化类器官模型。

3D类器官培养平台(OCTOPUS)的设计与制作
研究人员开发了一种能够产生径向排列的类器官阵列的圆盘状装置。该装置由八个相同的培养室组成,其横剖面尺寸为1毫米(高)× 1毫米(宽)。在这个系统中建立类器官培养只需要两个简单的步骤。首先,将悬浮在水凝胶中的干细胞通过入口处转移至中央腔室,并均匀分布到培养腔室中。然后,在凝胶化后,在含有装置的孔中加入培养基,通过水凝胶表面为嵌入的细胞提供营养供应。该装置具有易于转移、培养室的数量、大小和形状易于改变、可培养多种类器官和适配于标准培养板等优点(图1)。

图1. OCTOPUS装置
在OCTOPUS中肠类器官的长期培养
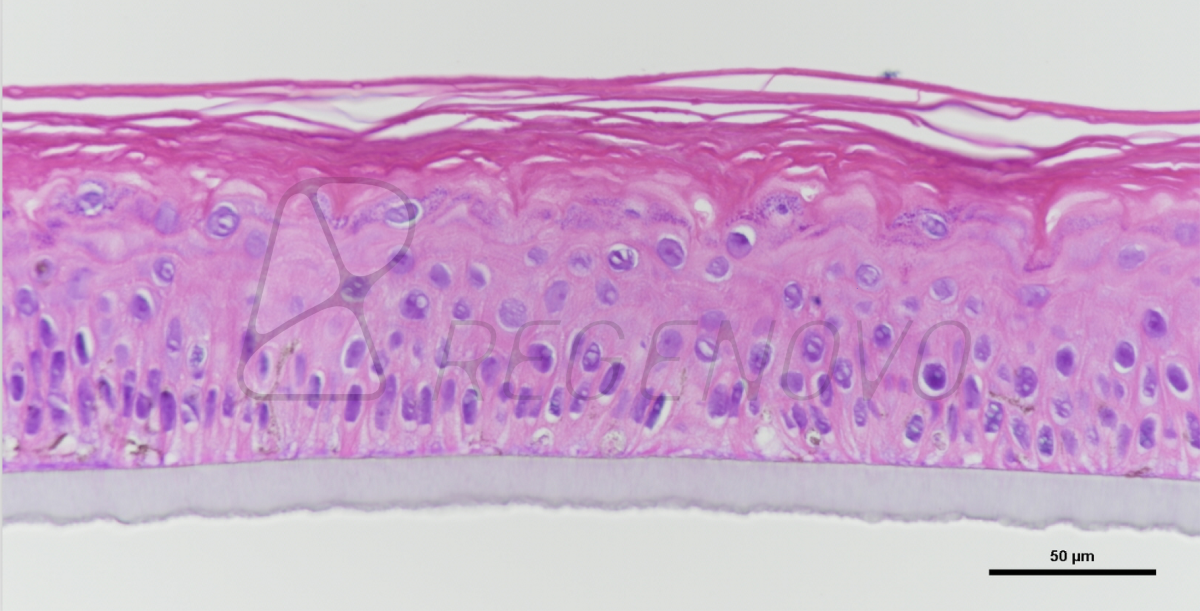
为了探究OCTOPUS能否延长类器官的培养周期,研究人员在OCTOPUS中培养来源干细胞的小鼠小肠类器官。实验结果表明,与传统培养技术相比,OCTOPUS培养的类器官具有更高的活力并且OCTOPUS的培养环境允许类器官持续生长超过3周而不传代(图2 a-g)。为了研究在OCTOPUS中长期培养是否能促进小鼠肠类器官的结构和功能成熟,研究人员检查了类器官芽的形成。与传统培养技术相比,OCTOPUS中类器官芽数和长度更大,芽端增殖活性增加。此外,在OCTOPUS中类器官肠上皮细胞的特异性标记物表达增多。这些结果表明OCTOPUS中类器官结构和功能成熟度的提高(图2 h-n)。

图2. 长期培养对OCTOPUS肠道类器官成熟的影响
OCTOPUS中的人类肠道类器官及其单细胞分析
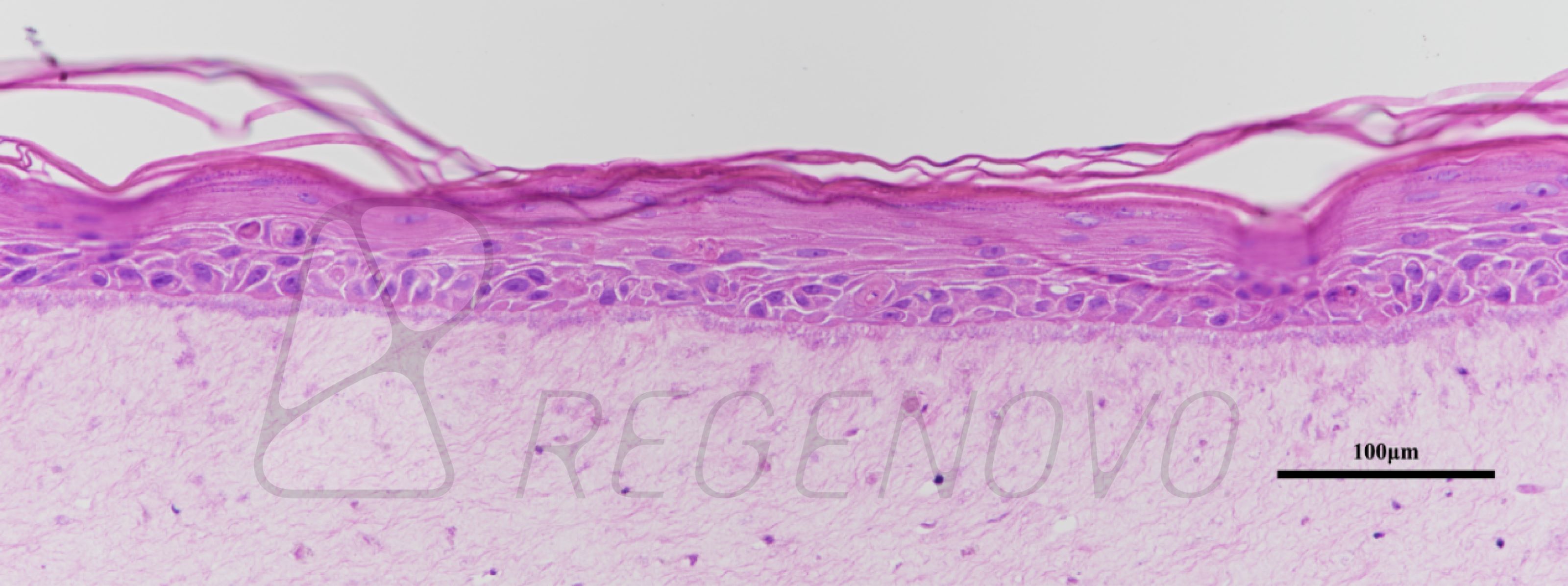
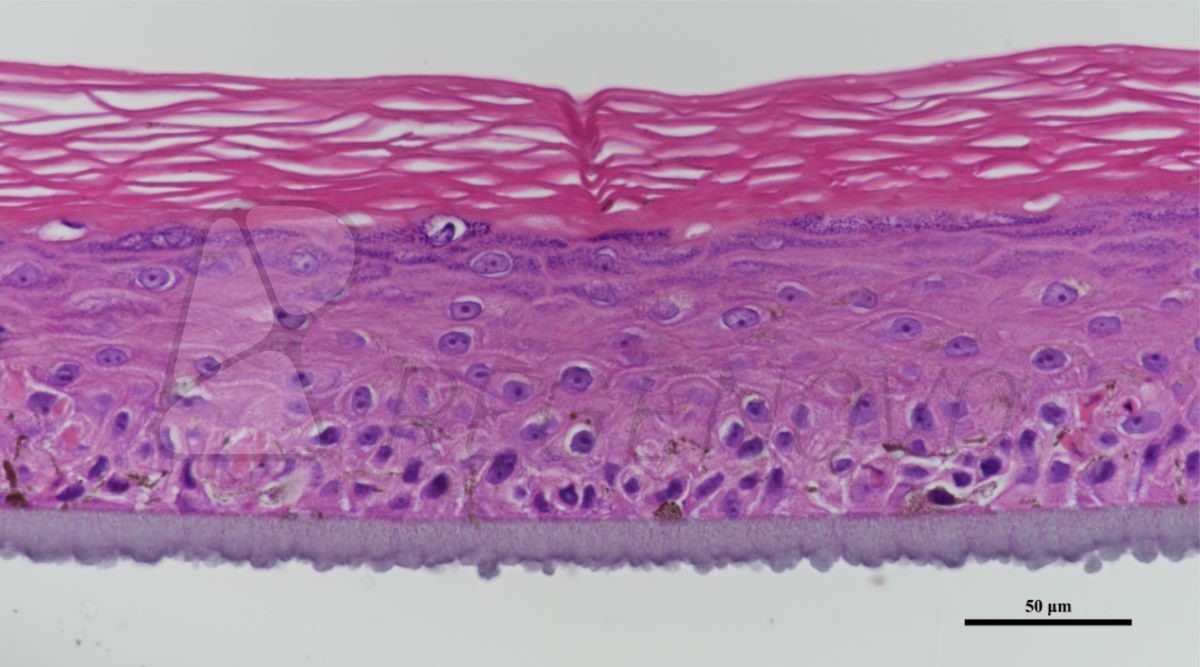
在用小鼠类器官证明了该平台的可行性后,研究人员在OCTOPUS中培养从健康供体的末端回肠分离的干细胞。实验结果表明,干细胞在OCTOPUS中5天内形成球形类器官,并随着培养天数的增加,形成芽结构。相比之下,用传统技术培养的肠类器官大多保持球形,很少有芽。而在OCTOPUS中的类器官可连续培养超过1个月而不传代,其大小增加了32倍以上,并产生了具有广泛上皮折叠的人类肠样体(图3 a-g)。对培养的类器官进行更进一步的表征发现,在OCTOPUS中长时间培养的类器官上皮分化增强(图3 h-n)。

图3. OCTOPUS中人类肠道类器官的长时间培养
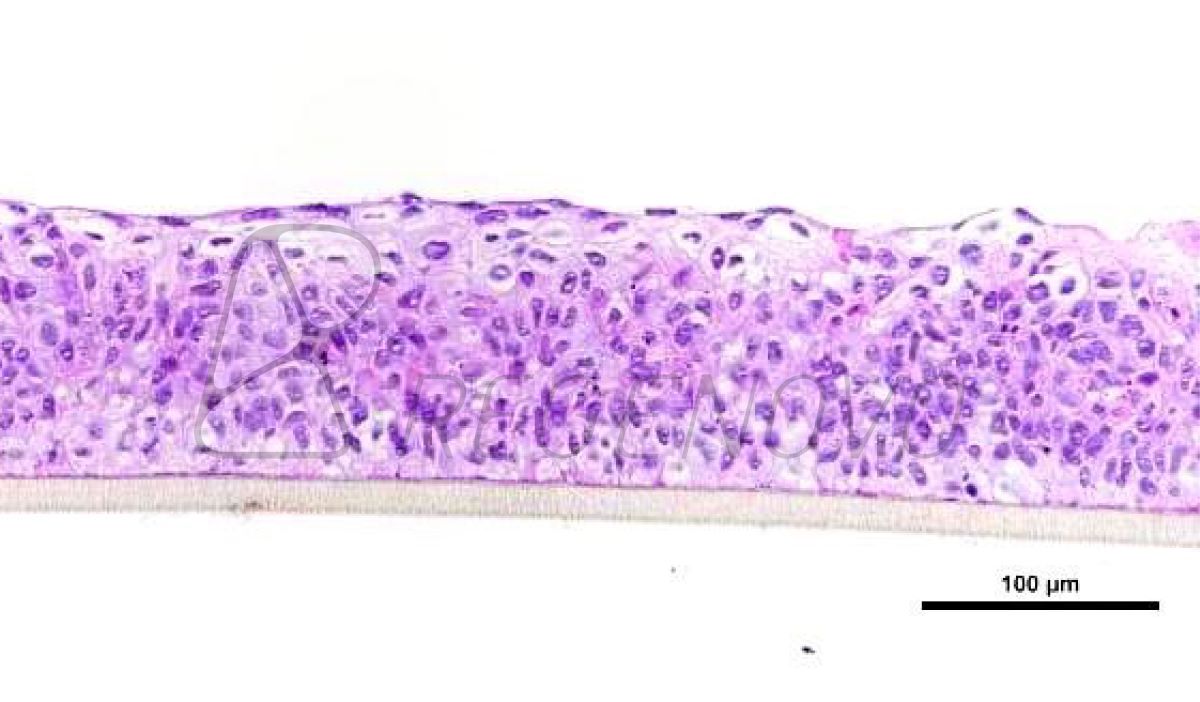
接下来,研究人员进行了单细胞RNA测序(scRNA-seq),以检查人肠类细胞的异质性及其单细胞转录谱。实验结果表明,在第7天,OCTOPUS类器官中产生了三组细胞,分别为吸收细胞、分泌细胞和干细胞,而每组细胞都包含多个亚群(图4)。
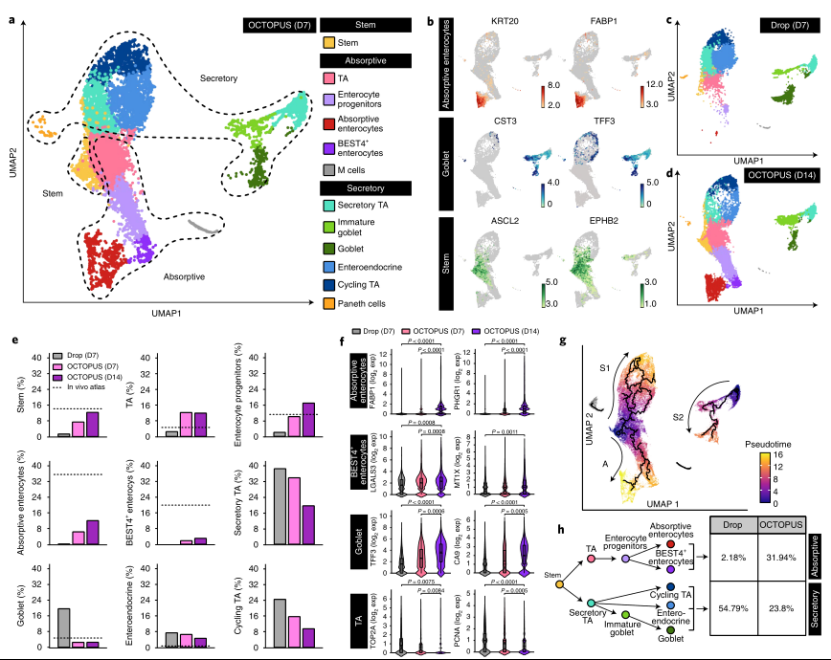
图4. OCTOPUS中人类肠道类器官的单细胞分析
OCTOPUS中建立人炎性肠病模型
为了在体外构建炎性肠病(IBD)的类器官模型,研究人员在OCTOPUS中培养来自克罗恩病儿科患者的肠干细胞。实验结果证明,OCTOPUS允许这些细胞发育成类似于健康供体的类器官,但IBD类器官生长更慢,形成的芽更少,存在形态学差异,且增殖能力降低、细胞凋亡增加。此外,IBD类器官绒毛域上皮屏障完整性受损(图5 a-l)。为了对肠道纤维化进行建模,研究人员将患者源性IBD肠干细胞与原代人肠道成纤维细胞共培养,以产生一种多细胞结构。培养14天后,IBD构建体在水凝胶支架中出现过多的纤维连接蛋白(FN)沉积,条件培养基中释放的FN水平显著升高,这表明病变上皮驱动的自发纤维化组织重塑(图5m-q)。
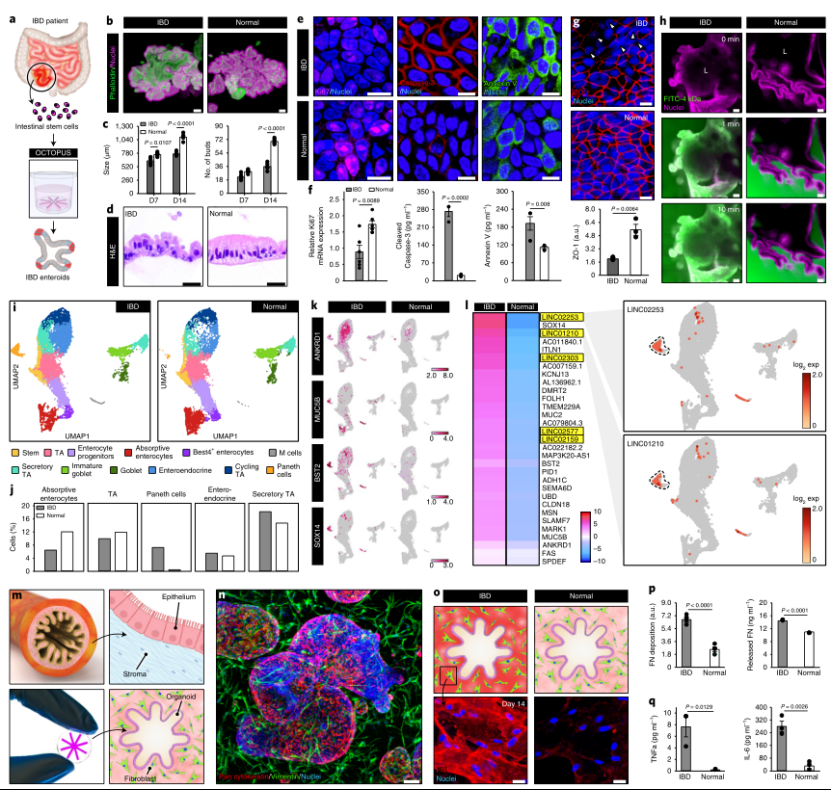
图5. OCTOPUS中IBD模型
在OCTOPUS中建立可灌注血管化类器官模型
为了构建可灌注的血管化类器官模型,研究人员改进了OCTOPUS装置,在培养腔中注入由人肠干细胞、内皮细胞和成纤维细胞组成的水凝胶溶液,在侧通道中植入内皮细胞,形成连续的内皮内膜。在培养过程中,水凝胶中的干细胞变成类器官,而嵌入在同一凝胶中的内皮细胞自组装成一个相互连接的血管三维网络(图6 a-g)。然后,为了验证该平台是否可以用于IBD类器官的血管化,研究人员将患者来源的肠干细胞、内皮细胞和成纤维细胞培养12天,得到了完全被周围微血管包围的IBD肠类器官(图6 h-n)。

图6. 血管化的类器官构建
结论
总的来说,研究人员开发了一个简单的、即用的微制造平台,来重新配置传统类器官模型的三维结构,从而设计出一个更均匀、无限制的可溶性微环境,有利于类器官的持续长期培养。OCTOPUS可以增加类器官的大小和成熟度,超过使用常规技术所能达到的程度,并且可以生产更真实的多细胞构建体,用于器官发生和疾病发展的体外建模。该平台具有较低的门槛,并减少了工程类器官的感知复杂性和实验负担,同时仍具有灵活性,以适应更复杂的类器官培养设计。
【原文信息】
DOI: 10.1038/s41592-022-01643-8