乳腺癌是全球女性发病率和死亡率最高的癌症。目前,乳腺癌亚型之一的三阴性乳腺癌(TNBC)因缺乏明确的分子靶点,且疾病后期出现明显的疾病耐药性而成为预后最差的乳腺癌类型,因此探索其疾病发展的分子机制及治疗癌细胞耐药性的方法对改善三阴性乳腺癌患者的预后意义重大。近日,贝勒医学院(休斯顿)Jeffrey M. Rosen 教授团队在Nature communications期刊发表文章Morphological screening of mesenchymal mammary tumor organoids to identify drugs that reverse epithelial-mesenchymal transition,该研究提出对于间充质乳腺肿瘤类器官进行形态学分析,并结合深度神经网络(dNN)和K最近邻分类算法(k-NN)的方法,成功实现对逆转乳腺癌细胞上皮-间充质转变过程(EMT)的药物筛选,以此为乳腺癌提供新的治疗方法,提高癌症细胞的化疗敏感性,并克服癌细胞耐药性。
一、三阴性乳腺癌细胞的上皮-间质转化过程
乳腺癌的发生、发展、侵袭和转移与上皮间质转化(epithelial mesenchymal transition,EMT)密切相关。上皮-间质转化(EMT)指在一定条件下通过特定的程序,细胞上皮细胞表型(圆形、多角形)转化为间质细胞表型(梭形),同时赋予癌细胞转移性、侵袭性、抗凋亡性和化疗耐药性,使得癌症治疗难度增加,因此探索能够改变该转化进程的药物,对治疗癌症疾病意义重大。三阴性乳腺癌(TNBC)为缺乏雌激素受体(ER)、孕激素受体(PR)以及人表皮生长因子2(HER-2)表达的一类癌症,claudin-low亚型乳腺癌则为该肿瘤群体4种亚型中间质特征最明显的一类癌症。研究表明miR-200是实现间质-上皮转化的主调控因子,在其实现表达后,claudin-low肿瘤类器官形态由延伸的"尖峰"状(侵袭性强)转为更平滑的圆形形态(侵袭性弱)。因此,确定能够表征mR-200因子并将细胞重新编程为上皮状态,实现间充质-上皮转化过程(MET)的药物可为三阴性乳腺癌提供新的治疗策略。
二、通过诱导miR-200c表达实现EMT逆转
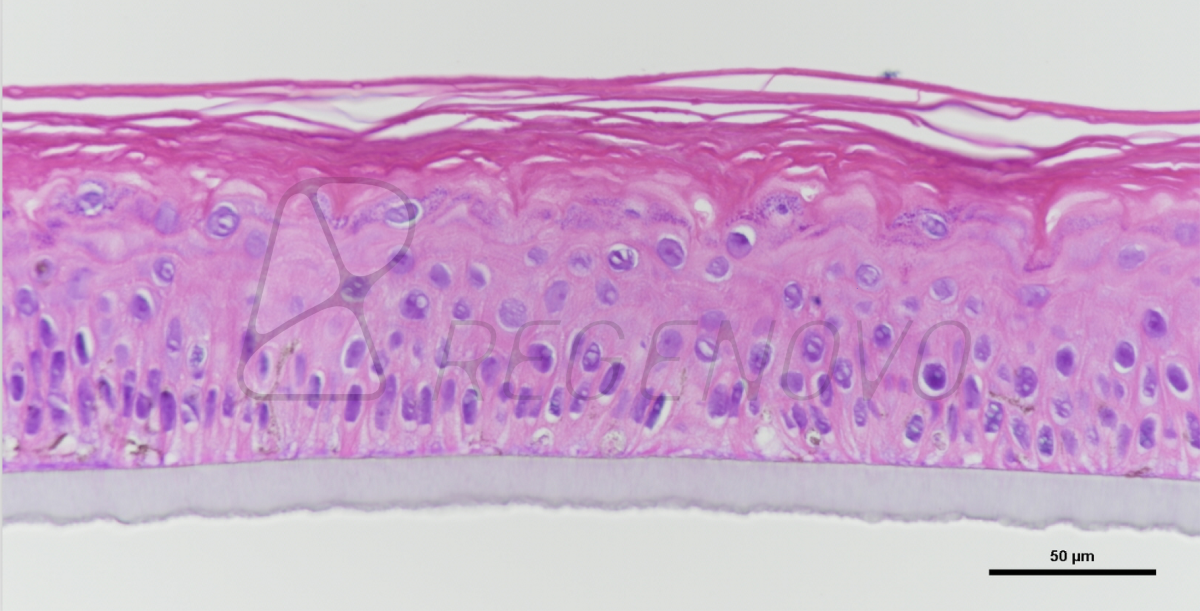
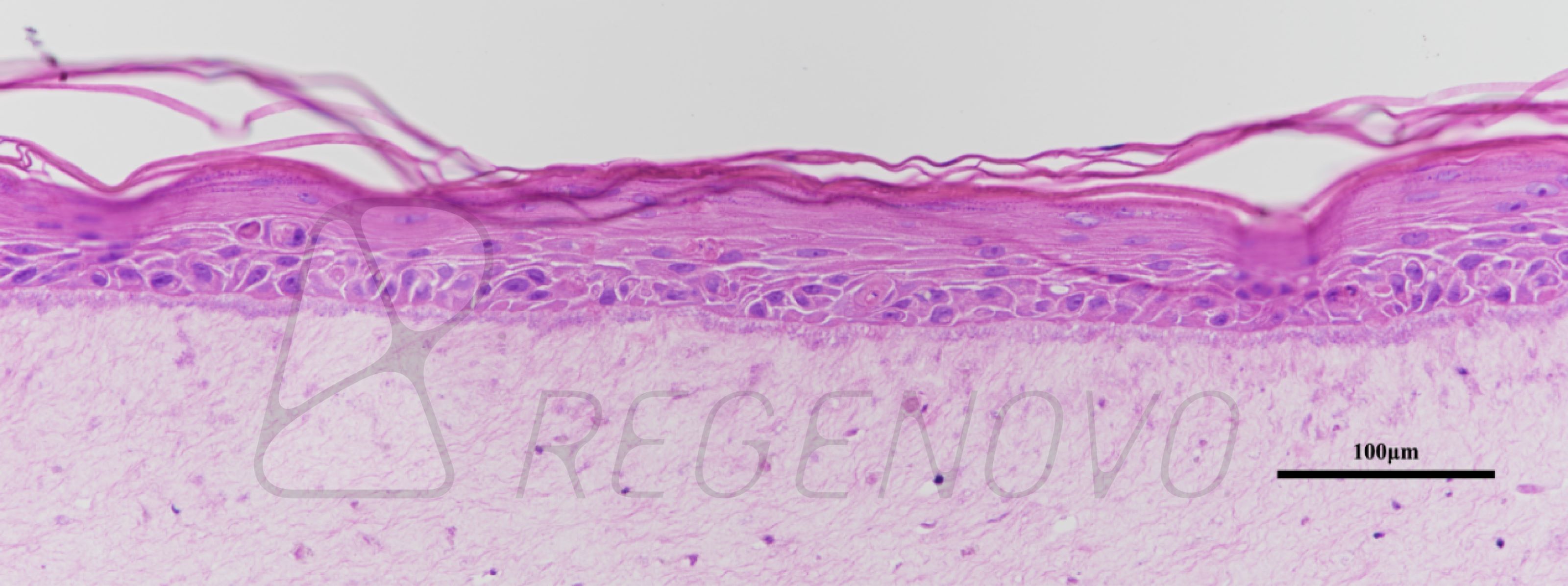
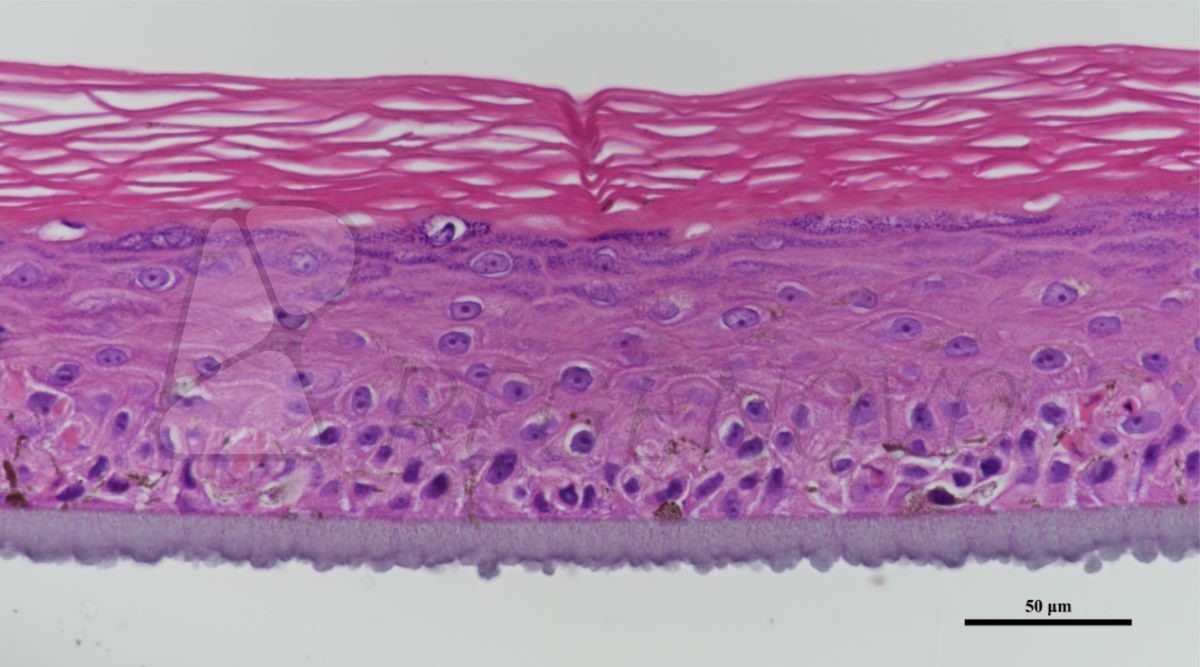
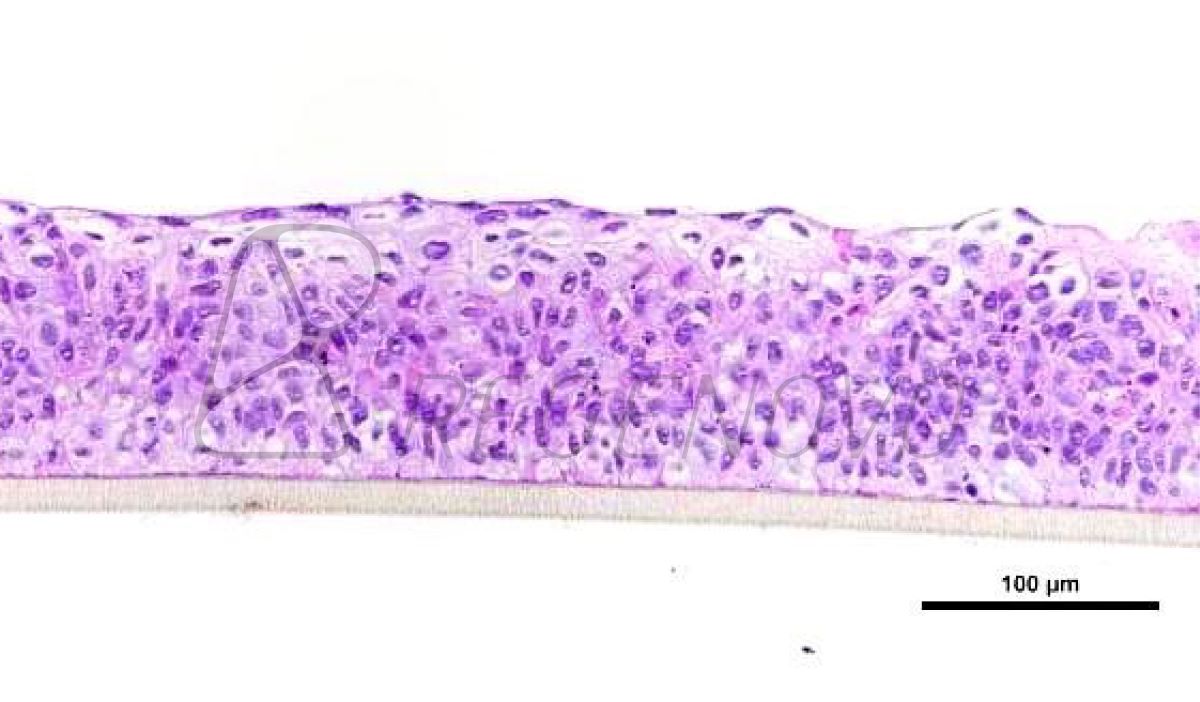
该研究分别以trp53缺失的两个乳腺肿瘤模型T11和T12为实验对象(图1a),通过诱导miR-200c在细胞中的表达(图1b), 发现上皮细胞特征性标志物细胞角蛋白K8在RNA和蛋白质水平得到显著表达(图1c),类器官中的细胞由侵袭性状态转为无侵袭性状态(图1d)。此外Z-cad报告基因分析、免疫印迹和免疫染色结果表明,miR-200c因子表达能够促进上皮质标记物E-cadherin钙粘蛋白的表达,降低间充质转录因子Zeb1的表达(图1e、f)。这种类器官由尖刺到圆形形态开关的形貌变化为EMT/MET动态转变提供了一个独特的实时读出方式,使得利用三维类器官图像的形态筛选方法来识别可以改变EMT/MET进程的小分子成为可能。
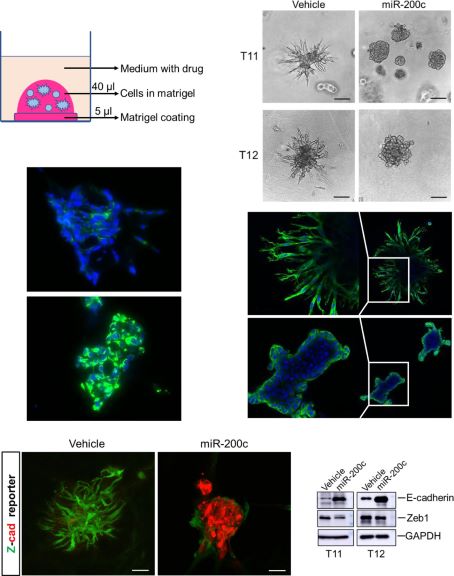
图1.通过诱导miR-200c表达来逆转EMT的类器官形态改变示意图
三、间充质乳腺肿瘤类器官细胞的形态学筛选助力逆转EMT药物研究
近年来,类器官(Organoid)技术的发展为细胞行为分析和个性化医学应用提供了新的发展思路。由于类器官可以维持细胞-细胞之间的相互作用,在组织学和转录组学方面显示出与原始组织更多的相似性,可为乳腺肿瘤治疗反应提供更准确的预测。迄今为止,依靠类器官培养,已实现了数种药物筛选。因此开发一个重编程EMT的形态学筛选平台,可为药物筛选提供有利的工具。而基于深度神经网络(dNN)架构的图像分析类型的发展可对原始图像直接分析,并提供了一种综合方法将图像特征提取(通常使用卷积层和池化层实现)与使用人工神经网络的分类任务相结合。研究通过结合经过预训练dNN模型的一般图像特征与k-最近邻模型(k-NN),绘制实验处理组与参考对照组的相似性,成功在表观遗传药物筛选中发现了一些可以逆转EMT的小分子抑制剂(图2)。
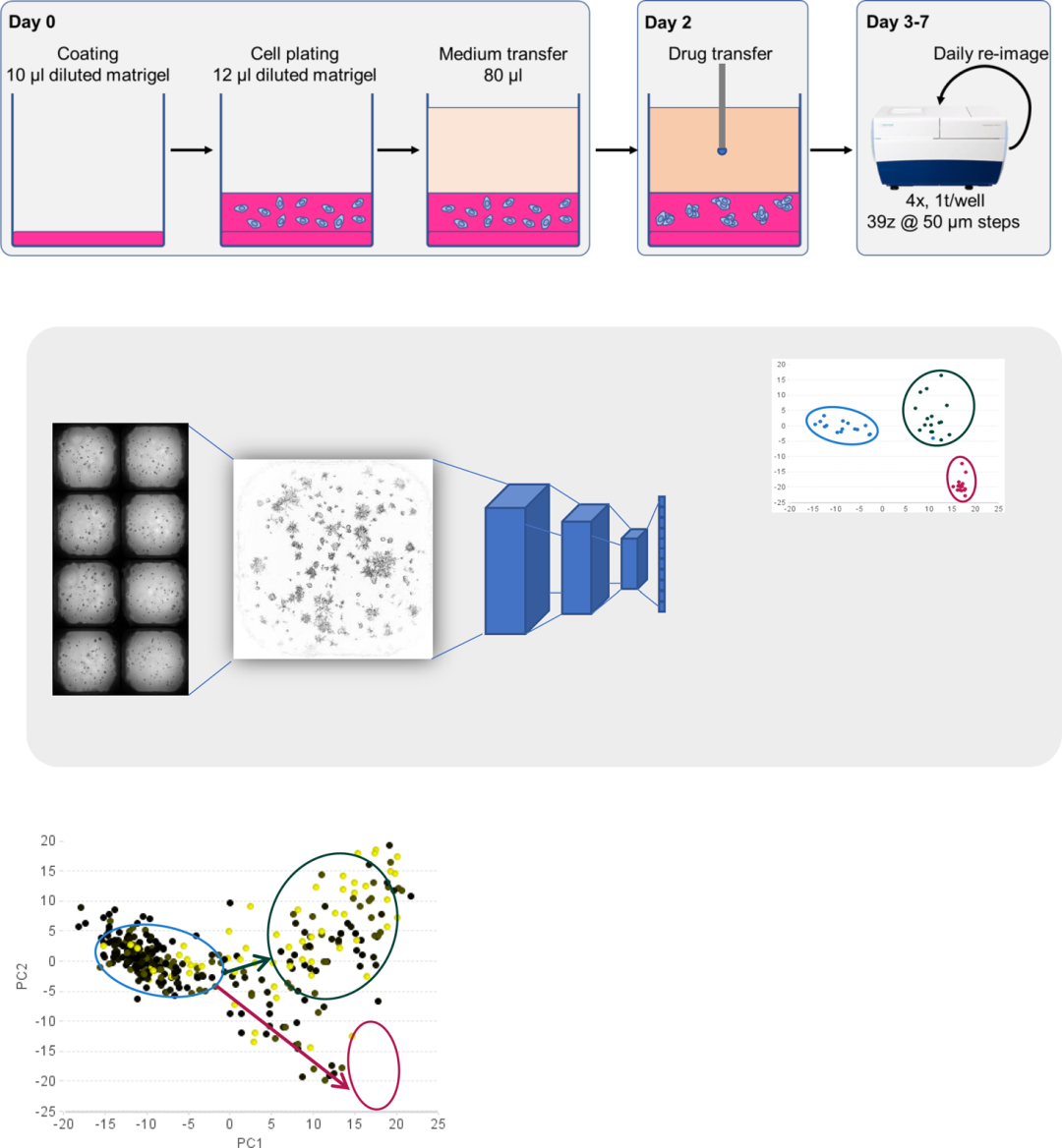
图2. 三维类器官培养与RESNET分析方法的演示结果
四、逆转EMT进程的表观遗传小分子抑制剂筛选鉴定
在T11和T12模型中,实验发现HDAC和BRD抑制剂可作为与miR-200具有同样诱导效果的药物类别(图3a)。在claudin-low乳腺癌模型中,数据结果之间的广泛重叠表明HDACs和BRD蛋白是EMT的共同调节因子(图3b)。
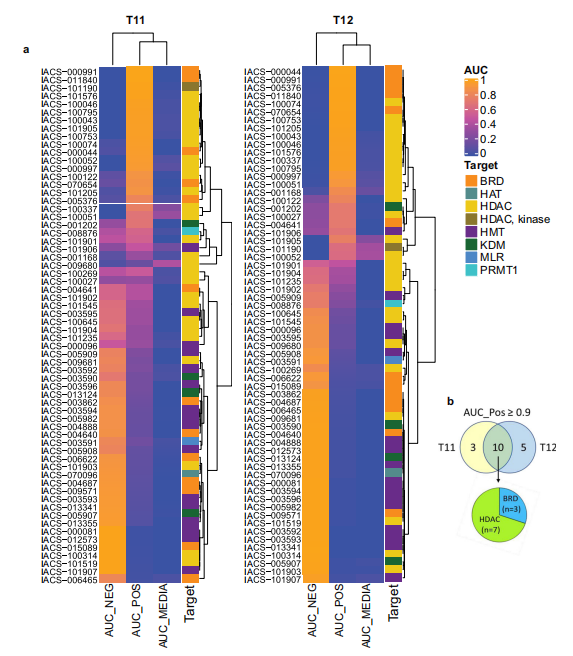
图3.逆转EMT表观遗传药物筛选结果
五、逆转EMT试剂验证
在蛋白免疫印迹检测中,研究人员在经过Fimepinostat(HDAC抑制剂)处理后的T11 和 T12模型中,观察到上皮标志物 E-cadherin发生显著表达(图 4a,b)。同时研究发现BRD抑制剂亦可相应减少诱导EMT进程的Slug 蛋白和 RNA 的表达,由此癌细胞实现由间质细胞表型到上皮细胞表型的转变(图 4a-d)。综上所述,T11和T12两个类器官模型进行的这些研究,表明claudin-low类器官的形态学筛选在识别 EMT 重编程药物方面呈现高精度和高灵敏度特点,由此在三阴性乳腺癌药物筛选方面具有较好的发展空间。
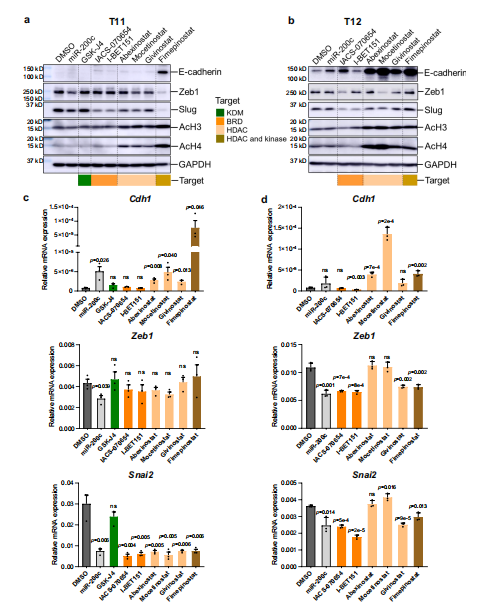
图4 . HDAC和BRD 的I类蛋白的抑制剂逆转EMT实验表征
六、结束语
该研究将间充质乳腺肿瘤类器官的形态学筛选作为一种手段,结合深度神经网络(dNN)和k-最近邻模型(k-NN)的图像分析方法,成功实现对逆转乳腺癌细胞上皮-间充质转变过程(EMT)的药物筛选,这可为乳腺癌提供新的治疗方法。同时,研究中涉及的药物筛选方法可对更多其他药物库进行分析,这可以促进药物的快速再利用,以更好地用于癌症疾病治疗。
【原文信息】
Zhao, N., Powell, R. T., Yuan, X., Bae, G., Roarty, K. P., Stossi, F., … Rosen, J. M. Morphological screening of mesenchymal mammary tumor organoids to identify drugs that reverse epithelial-mesenchymal transition. Nature Communications, (2021)12:4262.