【导读】
癌症患者通常呈现出不同的肿瘤表型,并且肿瘤在疾病发展和临床治疗过程中不断发生动态演变,由此产生的肿瘤特异性往往成为治疗癌症患者的最大阻碍。近年来,肿瘤类器官作为源于患者组织的肿瘤细胞通过3D自组装形成的一种器官模型,由于它能在体外稳定保留母瘤的遗传、蛋白质组学、形态学和药学特征,肿瘤类器官为癌症疾病模型构建和药物筛选提供了强大的平台。但目前肿瘤类器官培养技术在包括肿瘤组织来源和后续处理、培养基配方与动物源性三维基质等方面都没有标准化的流程,所以表现出不可控和不可重复的特点,以上所述的这些局限性都不利于精准模拟肿瘤类器官特异性及对肿瘤疾病发展的预测。近日,斯坦福大学Sarah C. Heilshorn教授团队在Nature Materials上发表的综述文章Next-generation cancer organoids则综合讨论了当前在类器官培养流程中存在的局限性及有助于肿瘤类器官培养标准化、规模化与保留肿瘤特异性的方法,并对提高类器官培养可控性和可重复性的研究工作提出了展望。
肿瘤组织来源和后续处理存在的缺陷及标准化培养流程进展
近年来,在肿瘤类器官的培养技术发展过程中,用于类器官培育而进行的肿瘤组织来源选择及其后续处理的方法发生了很大的变化(图1)。但由于在肿瘤组织来源选择和后续处理上仍旧没有标准化流程,这在根本上会影响类器官生成。
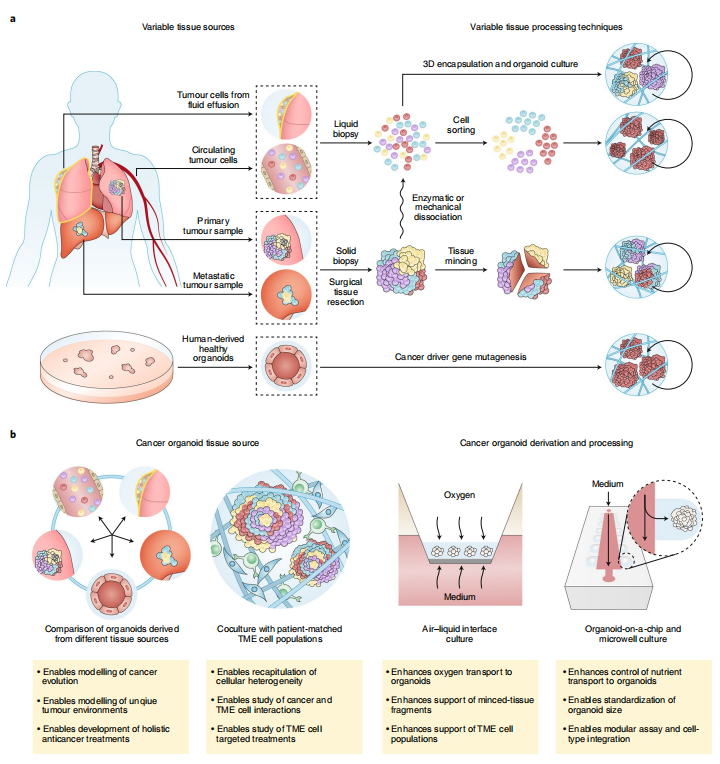
图1肿瘤类器官培育受到非标准化方法组织获取和处理的限制图示
肿瘤组织来源
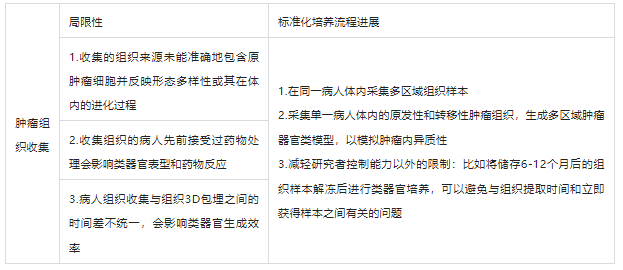
通常肿瘤类器官来源于原发肿瘤、转移性肿瘤、循环肿瘤和积液中的肿瘤细胞,这些细胞通过包括固体和液体活组织检查、手术切除和快速尸检在内的多种技术收集后包埋在3D基质中,用于类器官培养。为保留患者特异性的肿瘤类器官,往往需要反映肿瘤时空多样性的组织样本。然而目前的肿瘤类器官模型主要来源于单个活组织检查或手术切除组织的小碎片,因此不能准确地包含母体肿瘤的细胞并反映形态多样性或其在体内的进化过程(表1)。
表1 肿瘤组织收集在类器官培养中存在的缺陷及促进标准化培养流程的进展
肿瘤组织后处理方式
肿瘤组织后处理方式同样会对肿瘤类器官培养标准化产生很大影响。目前常用的两种组织处理方法为:(1)单细胞的完全组织解离和封装;(2)通过酶解和机械作用切碎组织并用3D封装毫米尺度的肿瘤碎片。目前这两种处理方式在标准化流程方面仍旧存在一定局限性(表2)。
表2 肿瘤组织处理方式在类器官培养中存在的缺陷及促进标准化培养流程的进展

类器官培养基配方存在的缺陷及标准化培养流程进展
研究表明肿瘤细胞的特异性遗传和表型发生需要独特的培养基配方。目前癌症类器官培养基的组分(例如纯化生长因子、条件培养基和动物源血清)是非常昂贵的,且具有不可复制和高度异质性,不利于构建具有患者特异性的肿瘤模型(图2)。
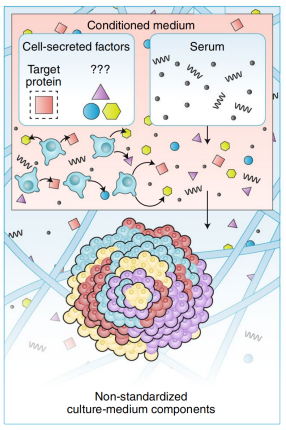
图2 肿瘤类器官培养在培养基上存在的局限性
生长因子和条件培养基
癌症的异质性部分是由几种TME(tumor microenvironment)细胞类型(包括成纤维细胞、免疫细胞、内皮细胞等)之间相互作用的可溶性因子信号传导所导致的。大多数肿瘤类器官模型由纯肿瘤细胞群组成,所以促进癌细胞生长的信号因子(通常在体内由TME细胞分泌)必须通过培养基从外部补充,由此在类器官培养中存在的局限性见表3。
表3 培养基配方在类器官培养中存在的缺陷及促进标准化培养流程的进展

动物血清
动物血清作为肿瘤类器官培养基质成分之一,具有成本高昂、可重复性差且高度异质性的特点。而如果直接或间接将动物源血清包含在肿瘤类器官培养基配方中,则会导致培养条件非标准化,影响类器官培养(表4)。
表4 动物血清在类器官培养中存在的缺陷及促进标准化培养流程的进展
动物源性基质存在的缺陷及标准化培养流程进展
体内ECM(extracellular matrix)是由蛋白质、多糖和蛋白聚糖组成,具有结构和生化功能的动态网络聚合物。与健康组织相比,肿瘤组织会对周围ECM的组成、结构和力学进行无序重构,并通过一系列生化相互作用影响肿瘤和肿瘤微环境细胞生物学(图3)。虽然肿瘤类器官模型为再现三维肿瘤ECM组成、结构、力学性能提供了新的研究思路,但目前还没有展开全面的研究来探索特异性ECM是如何影响患者来源的肿瘤类器官发病机制和体外抗癌治疗反应。目前大多数肿瘤类器官最常用的两类培养基质(即EHS(Engelbreth-Holm-Swarm)基质和胶原蛋白)仍旧存在一定局限性,影响了类器官培养标准化以及限制了对类器官和细胞外基质相互作用的机制理解。
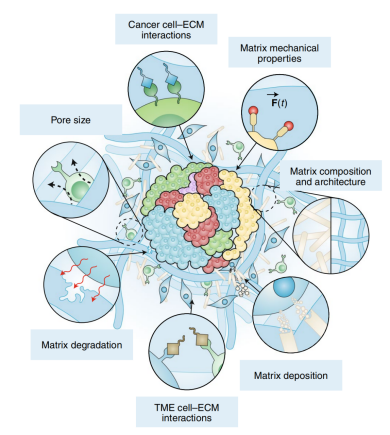
图3 ECM通过生化和机械相互作用影响肿瘤类器官表型示意图
小鼠EHS基质
EHS基质是研究中用于健康和肿瘤类器官3D培养最常见的基质。在提取小鼠肿瘤后,主要的2种ECM蛋白-层粘连蛋白(约60%)和IV型胶原(约30%)被保留在重组EHS基质中,为最终被包裹的细胞提供结构和生物支持。EHS基质能够提供丰富的肿瘤源性ECM成分、生长因子和细胞因子的环境,使多种肿瘤和TME细胞类型的增殖和维持成为可能,因此在癌症类器官研究中被广泛采用。同时EHS基质凝胶化过程较简单,可为许多肿瘤类器官亚型建立与肿瘤相关的环境,利于为患者特异性癌症生物学模型提供体外研究。但它仍旧存在一些缺陷,阻碍类器官培养标准化进程(表5)。
表5 EHS基质在类器官培养中存在的缺陷及促进标准化培养流程的进展

胶原蛋白基质
研究表明在许多实体肿瘤中,极端的结缔组织增生反应通常与胶原蛋白(通常为I-IV型)沉积和重塑增加有关。这种胶原蛋白的增加通过复杂的生化和生物物理信号线索调控癌症的几个方面。因此,I型胶原蛋白基质已经成为体外类肿瘤模型中EHS基质的一种越来越常见的更具成本效益的替代品。然而由于基质提取与应用过程中的非标准流程,对精准培育特异性肿瘤类器官模型产生了阻碍(表6)。
表6 胶原蛋白基质在类器官培养中存在的缺陷及促进标准化培养流程的进展

结束语
每种癌症模型在再现患者肿瘤特异性方面都有固有的局限性,因此选择合适的模型是每项研究成功的基础。随着对癌症的发病原因和治疗方法的不断深入了解,改进和促使这些类器官模型标准化也变得越来越重要。未来实施这些技术以改善肿瘤类器官培养条件将需要临床医生、生物学家和工程师的跨学科努力。总的来说,构建强大的肿瘤模型将重塑未来医疗人员进行个性化护理的方式,并加速临床有效治疗的转化,从而极大地改善患者的预后。
【原文信息】
LeSavage B L, Suhar R A, Broguiere N, et al. Next-generation cancer organoids[J]. Nature Materials, 2022, 21(2): 143-159.
“ 良方 ” 实验装置介绍
细胞、类器官与组织的智能自动化实验装置“良方”